主办:佑安肝病感染病专科医疗联盟遗传代谢性肝病专业委员会,中华医学会肝病学分会遗传代谢性肝病协作组
总编辑:段钟平
本期责任主编:侯维
执行编辑:郑素军,於海天,张思琪,侯维
本期目录
一、主编致辞
二、学术进展
三、临床资讯
四、联系方式
月报撰稿及简评专家主要为中华医学会肝病学分会遗传代谢性肝病协作组、佑安肝病感染病专科医疗联盟遗传代谢性肝病专业委员会,以及其他相关领域专家。
“学术进展”:速览最新重要文献,了解遗传代谢性肝病的科研前沿!
“临床资讯”:提供典型病例、名家讲座等信息,共享临床诊治奥妙!
一、主编致辞
肝豆状核变性(Wilson disease ,WD)是一种由铜代谢障碍引起的遗传性疾病,主要特征为铜在多个器官(尤其是肝脏和大脑)的病理性蓄积[1]。该病由ATP7B基因的纯合或复合杂合突变(即携带两种不同的致病突变等位基因)所致。ATP7B基因编码一种跨膜铜转运ATP酶,其功能包括介导铜排泄至胆汁中,并为血清铜蓝蛋白(血液中主要含铜蛋白)的功能性合成提供铜[2]。在WD患者中,ATP7B功能缺陷导致肝细胞内铜过载,并引发相应的肝脏病理改变。过量的铜还会释放入血液循环,继而在其他组织(尤其是大脑)中发生病理性蓄积,最终可能导致神经系统症状及精神障碍。WD临床表现多样,最常见于5至35岁人群。本病较为罕见,有症状患者的患病率估计约为1/30,000;然而,近期分子遗传学研究显示,携带两个致病突变等位基因的遗传性WD患病率可能更高。WD属于少数在早期诊断和正确治疗下可获得良好管理的遗传性疾病[3];但若不及时治疗,该病具有普遍致死性[4]。
WD的临床症状主要由过量铜的毒性作用及其引发的组织病理学改变所致[5]。WD的血液中存在不稳定的非铜蓝蛋白结合铜——即与白蛋白及其他分子松散结合且易于发生化学反应的离子态铜。几乎所有组织都会持续摄取这些铜离子,可能通过铜转运蛋白(CTR1)和二价金属转运蛋白1(DMT1)介导实现。过量铜在组织中的毒性作用,主要归因于其氧化还原活性引发的氧化应激,进而导致脂质、蛋白质、DNA和RNA等生物分子损伤。铜毒性的其他潜在机制还包括:通过激活酸性鞘磷脂酶诱导细胞凋亡,从而触发凋亡第二信使神经酰胺的释放[6];以及通过非特异性结合蛋白质巯基而直接抑制多种酶的活性[7]。在亚细胞层面,线粒体是铜诱导毒性最敏感的靶标之一[8]。威尔逊病(WD)是一种由ATP7B基因突变引起的铜代谢障碍性疾病。
肝脏作为铜稳态调节的核心器官及ATP7B蛋白表达的主要部位,常最先受累。约40%-60%的患者以肝病为首发表现,其临床谱系广泛,可从无症状的肝酶升高、急性肝炎样表现,逐步发展为肝硬化甚至急性肝衰竭。目前,WD的基因型与临床表型之间尚未建立明确的相关性。
在肝脏表现之后,神经系统症状成为WD最常见的临床征象。患者多在20-30岁出现神经症状,主要表现为多种运动障碍。其中,震颤(约55%)、肌张力障碍(11%-65%)及帕金森综合征(19%-62%)最为常见。肌张力障碍可呈现特征性的“讥笑面容”。此外,构音障碍发生率极高(可达97%),部分患者可因严重构音障碍丧失言语能力;吞咽困难(约50%)与流涎(约68%)也较为常见,二者常伴随出现,并可导致吸入性肺炎等严重并发症。共济失调(约30%)则多与其他运动障碍合并存在。这些症状常相互重叠,进行性加重,严重影响患者的日常活动与生活质量。
WD除累及肝脏和神经系统外,也可影响肾脏、肌肉骨骼、心脏及内分泌等其他器官系统。骨关节炎作为一种相对少见的临床表现,已在部分小样本病例系列中被报道[9]。该病变主要侵犯承重关节(如膝、髋及脊柱),亦可累及其他关节。研究显示,多数WD患者的骨关节炎起病于青少年或成年早期,属于早发性骨关节炎(POA)。其发病机制可能与关节内铜过量蓄积导致的组织损伤有关[10]。POA(表现为骨关节炎样疼痛)可作为WD患者的首发症状,甚至可能在数年内作为唯一表现,从而造成误诊或漏诊[11]。曾有病例记录显示,一位WD患者以孤立性POA为主要表现长达15年[12]。目前关于孤立性POA患者的预后与自然病程仍缺乏描述,其相关的WD基因型也鲜有报道。
本期月报报道一例中年男性患者,其在WD典型的神经与肝脏表现之外,出现左膝关节肿胀、积液等显著骨关节症状,曾被考虑为普通关节炎但抗炎治疗无效。WD作为一种全身性代谢病,本身可导致早发性骨关节炎(POA),好发于膝、髋等承重关节。该患者WD病史长、治疗不规范,可能存在WD相关关节病变的基础。然而,追问病史该患者具有畜牧职业暴露史,后续布病检查阳性,且关节症状与布病感染在时间上关联密切,因此布病感染所致反应性关节炎成为首要考虑病因。经规范抗布病治疗后,其关节症状明显缓解。本案例提示,WD虽为罕见病,但也可能与其他疾病共存的情况,特别是WD的骨关节炎与布病的骨关节临床表现易重叠混淆,给我们的诊断造成了很大困难。当用一元论无法解释,或治疗效果不佳时,我们及时拓展思路,仔细询问病史,反复进行鉴别诊断。
参考文献:
[1] Bandmann O, Weiss KH, Kaler SG. Wilson's disease and other neurological copper disorders. Lancet Neurol. 2015 Jan;14(1):103-13. pii: S1474-4422(14)70190-5. doi: 10.1016/S1474-4422(14)70190-5. PubMed PMID: 25496901.
[2] Ferenci P. Regional distribution of mutations of the ATP7B gene in patients with Wilson disease: impact on genetic testing. Hum Genet. 2006 Sep;120(2):151-9. doi: 10.1007/s00439-006-0202-5. PubMed PMID: 16791614.
[3] Bandmann O, Weiss KH, Kaler SG. Wilson's disease and other neurological copper disorders. Lancet Neurol. 2015 Jan;14(1):103-13. pii: S1474-4422(14)70190-5. doi: 10.1016/S1474-4422(14)70190-5. PubMed PMID: 25496901.
Dzieżyc K, Karliński M, Litwin T, Członkowska A. Compliant treatment with anti-copper agents prevents clinically overt Wilson's disease in pre-symptomatic patients. Eur J Neurol. 2014 Feb;21(2):332-7. doi: 10.1111/ene.12320. PubMed PMID: 24313946.
[4] European Association for Study of Liver. EASL Clinical Practice Guidelines: Wilson's disease. J Hepatol. 2012 Mar;56(3):671-85. pii: S0168-8278(11)00812-9. doi: 10.1016/j.jhep.2011.11.007. PubMed PMID: 22340672.
Roberts EA, Schilsky ML, American Association for Study of Liver Diseases (AASLD). Diagnosis and treatment of Wilson disease: an update. Hepatology. 2008 Jun;47(6):2089-111. doi: 10.1002/hep.22261. PubMed PMID: 18506894.
Socha P, Janczyk W, Dhawan A, Baumann U, D'Antiga L, Tanner S, Iorio R, Vajro P, Houwen R, Fischler B, Dezsofi A, Hadzic N, Hierro L, Jahnel J, McLin V, Nobili V, Smets F, Verkade HJ, Debray D. Wilson's Disease in Children: A Position Paper by the Hepatology Committee of the European Society for Paediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2018 Feb;66(2):334-344. doi: 10.1097/MPG.0000000000001787. PubMed PMID: 29341979.
[5] CUMINGS JN. The copper and iron content of brain and liver in the normal and in hepato-lenticular degeneration. Brain. 1948 Dec;71(Pt. 4):410-5. doi: 10.1093/brain/71.4.410. PubMed PMID: 18124738.
[6] Lang PA, Schenck M, Nicolay JP, Becker JU, Kempe DS, Lupescu A, Koka S, Eisele K, Klarl BA, Rübben H, Schmid KW, Mann K, Hildenbrand S, Hefter H, Huber SM, Wieder T, Erhardt A, Häussinger D, Gulbins E, Lang F. Liver cell death and anemia in Wilson disease involve acid sphingomyelinase and ceramide. Nat Med. 2007 Feb;13(2):164-70. pii: nm1539. doi: 10.1038/nm1539. PubMed PMID: 17259995.
[7] Letelier ME, Sánchez-Jofré S, Peredo-Silva L, Cortés-Troncoso J, Aracena-Parks P. Mechanisms underlying iron and copper ions toxicity in biological systems: Pro-oxidant activity and protein-binding effects. Chem Biol Interact. 2010 Oct 6;188(1):220-7. pii: S0009-2797(10)00395-9. doi: 10.1016/j.cbi.2010.06.013. PubMed PMID: 20603110.
Mufti AR, Burstein E, Csomos RA, Graf PC, Wilkinson JC, Dick RD, Challa M, Son JK, Bratton SB, Su GL, Brewer GJ, Jakob U, Duckett CS. XIAP Is a copper binding protein deregulated in Wilson's disease and other copper toxicosis disorders. Mol Cell. 2006 Mar 17;21(6):775-85. pii: S1097-2765(06)00081-5. doi: 10.1016/j.molcel.2006.01.033. PubMed PMID: 16543147.
[8] Huster D, Finegold MJ, Morgan CT, Burkhead JL, Nixon R, Vanderwerf SM, Gilliam CT, Lutsenko S. Consequences of copper accumulation in the livers of the Atp7b-/- (Wilson disease gene) knockout mice. Am J Pathol. 2006 Feb;168(2):423-34. pii: S0002-9440(10)62103-7. doi: 10.2353/ajpath.2006.050312. PubMed PMID: 16436657.
[9] Canelas HM, Carvalho N, Scaff M, Vitule A, Barbosa ER, Azevedo EM. Osteoarthropathy of hepatolenticular degeneration. Acta Neurol Scand. 1978 Jun;57(6):481-7. doi: 10.1111/j.1600-0404.1978.tb02851.x. PubMed PMID: 696236.
Rodríguez Nieva N, Febrer Rotger A, Meléndez Plumed M, Vernet Bori A. [Osteoarthropathy in three siblings with Wilson's disease]. An Pediatr (Barc). 2004 Aug;61(2):181-4. pii: 13064600. doi: 10.1016/s1695-4033(04)78379-4. PubMed PMID: 15274886.
Golding DN, Walshe JM. Arthropathy of Wilson's disease. Study of clinical and radiological features in 32 patients. Ann Rheum Dis. 1977 Apr;36(2):99-111. doi: 10.1136/ard.36.2.99. PubMed PMID: 857745.
[10] Menerey KA, Eider W, Brewer GJ, Braunstein EM, Schumacher HR, Fox IH. The arthropathy of Wilson's disease: clinical and pathologic features. J Rheumatol. 1988 Feb;15(2):331-7. PubMed PMID: 3361541.
Kramer U, Weinberger A, Yarom R, Zoldan J, Bahar A, Godoth N. Synovial copper deposition as a possible explanation of arthropathy in Wilson's disease. Bull Hosp Jt Dis. 1993;52(2):46-9. PubMed PMID: 8443556.
[11] Deng XL, Liu XY, Xu N. Comparative study on low back pain misdiagnosed as spondyloarthropathy. Clin Rheumatol. 2009 Aug;28(8):893-8. doi: 10.1007/s10067-009-1198-8. PubMed PMID: 19449145.
Pan HY, Huang CY, Lai CL. Wilson's disease in a patient presenting with skeletal abnormalities. Orthopedics. 1985 Jun;8(6):742-4. doi: 10.3928/0147-7447-19850601-08. PubMed PMID: 4095001.
[12] Misra AK, Biswas A, Ganguly G, Ghosh A, Das SK, Roy T. Arthropathic presentation of Wilson's disease. J Assoc Physicians India. 2004 Mar;52:246-8. PubMed PMID: 15636319.

侯维
首都医科大学附属北京佑安医院,肝病中心一科,主任医师
中华医学会感染病学分会青年委员
北京感染病学分会委员
北京医学会肝病学分会青年委员
二、学术进展
Pubmed最新重要文献速览(长按文末二维码或“阅读原文”可下载)
1.EASL-ERN肝豆状核变性临床实践指南(Journal of Hepatology. 2025, IF=33.0; Q1区)
2.卵巢-肝脏轴:分子科学与流行病学(International journal of molecular sciences, 2025,IF=4.90; Q1区)
3.血浆置换改善Wilson指数≥11合并早期肝性脑病的肝豆状核变性患者自体肝生存率(Hepatology International,2025,IF=6.1;Q1区)
4.整合蛋白质组学与单细胞转录组学揭示肝豆状核变性患者的潜在治疗靶点(Frontiers in Immunology,2025,IF=5.9;Q1区)
5.肝豆状核变性相关肾损伤(Kidney International Reports,2025,IF=5.7;Q1区)
6.肝豆状核变性诊断中的常见误区(Current Neurology and Neuroscience Reports,2025,IF=5.2;Q1区)
7.肝豆状核变性患者的膳食质量与营养风险:一项横断面研究(Frontiers in Nutrition,2025,IF=5.1;Q1区)
8.相对可交换铜、可交换铜与总铜在肝豆状核变性诊断中的价值(Liver International,2025,IF=5.2;Q1区)
9.TDMQ20作为肝豆状核变性候选药物:与D-青霉胺、曲恩汀及四硫代钼酸盐的体内外比较研究(Pharmaceutics,2025,IF=5.2;Q1区)
10.肝型肝豆状核变性患者肝硬化的临床特征、治疗效果及危险因素分析(Journal of Clinical and Translational Hepatology,2025,IF=4.2;Q1区)
三、临床资讯
3.1 病例分享:膝关节肿胀并非都怪“铜”:一例肝豆状核变性患者骨关节症状的再思考
患者女性,47岁,因“间断肝功能异常10年”入院。
男性患者,38岁。因“发现肝豆状核变性12年”加重1月余。
现病史:患者12年前无诱因出现双手细颤,就诊于某三甲医院,查血清铜蓝蛋白0.041 g/L,进一步行基因检测提示ATP7B基因c.2333G>T和c.2621C>T复合杂合变异,明确诊断为肝豆状核变性,给予D-青霉胺及锌剂驱铜治疗,此后定期复查,病情稳定,肝功能基本正常。
6年前患者自行停药,未定期复查。2年前患者出现双手震颤,并逐渐加重,以左手为著,间断服用D-青霉胺0.375g po bid联合硫酸锌100mg po bid治疗,效果欠佳。11月前患者双手震颤加重,并出现构音障碍,不自主呻吟,卧位明显。5月前患者出现左膝关节肿胀,伴腰部,大腿皮疹。完善超声检查提示左膝关节液性暗区——积液可能。骨科专科考虑关节腔积液及关节炎,给予头孢克肟抗炎治疗无好转。近一月上述症状明显加重,为进一步治疗收入我院。
既往史及家族史:10年前曾因车祸行腰椎手术,术后恢复可。父母体健。余无特殊。
入院查体:生命体征平稳。神志清楚。构音障碍,肝掌、蜘蛛痣阴性,皮肤巩膜无黄染,心肺查体未及阳性体征。腹平软,无压痛、反跳痛,Murphy征阴性,胆囊触痛阴性,移动性浊音阴性。双下肢无水肿。
入院后检查:
24h尿铜检查273.3μg/24h,血清铜蓝蛋白0.04g/L,双眼KF环阳性。
血常规:WBC 7.1×109/L,HGB 157g/L,PLT 71×109/L,N% 64.9%。
肝功能:ALT 35U/L,AST 43U/L,GGT 63U/L,ALP 167U/L,TBIL 64.9μmol/L,DBIL 36.4μmol/L,ALB 28g/L。
凝血指标:PT 11.0, PTA 62.3%。
病因学:甲肝、乙肝、丙肝、戊肝等病毒学标志物阴性。
自身免疫抗体ANA 1:320 ,AMA(阴性),余均阴性。抗核抗体谱阴性。
腹部超声提示:弥漫性肝病表现,脾大,脾静脉增宽,胆囊壁毛糙增厚。未及腹水。
肝弹性:CAP 204db/m, E 32.7kPa。
腹部增强CT:肝硬化,脾大,侧枝循环形成,腹水少量,门脉右支、主干及肠系膜上静脉栓子,胆囊炎,右肾囊肿。
头颅MR:提示壳核及苍白球对称性T1WI 低信号、T2WI 高信号。符合肝豆状核变性表现。
电子胃镜检查提示食管胃底静脉曲张重度。
病情分析:
患者肝豆状核变性病史12年,目前莱比锡评分12分(KF环阳性2分;典型头颅MR表现2分;铜蓝蛋白<0.1g/L 2分;24小时尿铜>2×ULN 2分;基因诊断4分),诊断WD明确。近期出现双手震颤,构音障碍,并逐渐加重,出现不自主呻吟。同时还出现左膝关节肿胀、关节积液等显著骨关节症状,曾被考虑为普通关节炎但抗炎治疗无效。考虑患者近6年均未规律驱铜治疗,目前病情进展与铜蓄积相关,膝关节肿胀、关节积液也与铜沉积相关,遂应尽快开展有效驱铜治疗。考虑到患者肝脏已进展至肝硬化阶段,又有神经系统症状,青霉胺可能有加重神经系统症状的风险,二巯丁二酸胶囊驱铜作用偏弱,故给予二巯丙磺钠注射液静脉输注驱铜治疗,同时注意监测神经系统症状。
诊疗经过:
入院后给与二巯丙磺钠注射液750 mg/日,静点,连续5天为一疗程,间断治疗了4个疗程。同时给与多烯磷脂酰胆碱、水飞蓟素,补充白蛋白等保肝对症支持治疗。并请消化科会诊后给予内镜下食管胃底静脉曲张治疗进行一级预防。出院后序贯二巯丁二酸胶囊1000mg/d口服治疗+葡萄糖酸锌150mg/d口服治疗。约2个月后,患者手抖、不自主呻吟症状明显改善,构音障碍也较前减轻。复查24h尿铜517μg/24h,停用二巯丁二酸胶囊48小时后测24h尿铜132μg/24h。考虑驱铜治疗有效,继续二巯丁二酸胶囊1000mg/d口服+葡萄糖酸锌150mg/d口服治疗方案。但患者膝关节肿胀症状无改善,并出现腰痛明显。
WD除累及肝脏和神经系统外,也可影响骨关节。骨关节病并不常见,可表现为骨质疏松症、骨软化症、自发性骨折、佝偻病、剥脱性骨软骨炎、髌骨软骨软化症、过早骨质减少,以及膝盖和手腕的退行性关节炎等,与其他骨关节病在临床表现上难以区分。此患者驱铜治疗后神经系统症状明显改善,肝功稳定,但骨关节症状仍有加重是否能用一元论解释?我们当时的确无从下手,对于骨关节病的诊治也缺少经验,建议患者进一步骨科就诊。
2月前,患者就诊于当地医院骨科,化验虎红平板凝集试验阳性,试管凝集试验:滴度≥1:160,PCR检测阳性。完善膝关节磁共振,在失状位可见:股骨、胫骨下斑片状、弥漫样高信号,提示骨髓水肿/炎性浸润(图1),股骨前方、股四头肌腱下方高信号,提示髌上囊积液(图2)。
诊断布鲁氏菌病明确。给与多西环素100mg口服,每日2次 联合利福平600mg口服,每日1次,疗程6周。关节症状明显改善。
最终明确诊断:肝豆状核变性,布鲁氏菌病。
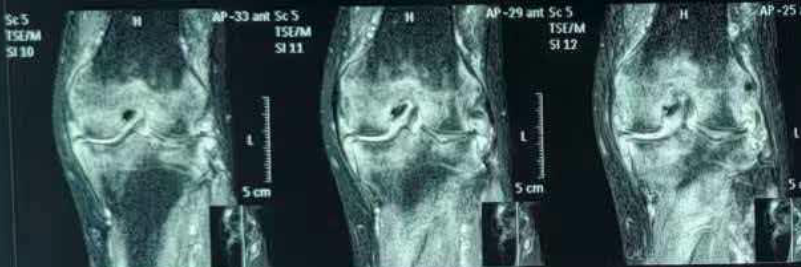
图1. 股骨、胫骨下斑片状、弥漫样高信号,提示骨髓水肿/炎性浸润
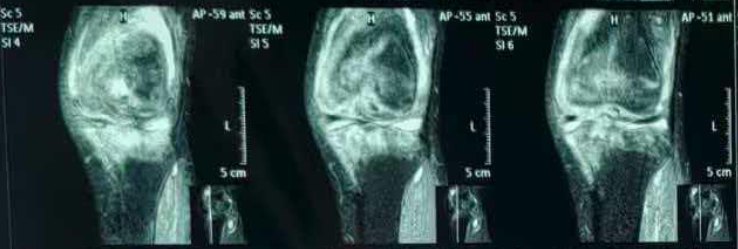
图2. 股骨前方、股四头肌腱下方高信号,提示髌上囊积液
3.2 供稿专家简介

侯维
首都医科大学附属北京佑安医院,肝病中心一科,主任医师
中华医学会感染病学分会青年委员
北京感染病学分会委员
北京医学会肝病学分会青年委员

张维
首都医科大学附属北京佑安医院,肝病中心一科,副主任医师
四、联系方式
▶投稿邮箱:yichuandaixie2020@163.com(用于征集典型病例、PPT或委员会动态信息)
▶联系电话:010-83997658
▶联系地址:北京市丰台区右安门外西头条8号佑安医院C楼7层

